- Blog
14/08/2025
’atteinte hépatique induite par les médicaments (DILI – Drug-Induced Liver Injury) est un problème majeur de santé publique. Elle représente à la fois un risque potentiellement mortel pour les patients et une cause importante d’abandon de molécules à toutes les étapes de leur cycle de vie, du développement préclinique à la Phase IV.
Le DILI est un diagnostic d’exclusion, ses symptômes apparaissant avec une latence variable et ressemblant à ceux d’autres pathologies (hépatite virale, allergies, maladie du foie associée à un syndrome métabolique, ou encore hépatite auto-immune). On distingue trois principaux profils biochimiques de manifestations hépatiques : hépatite aiguë, cholestase et forme mixte. Le DILI peut être classé en dose-dépendant (intrinsèque) ou non dose-dépendant (idiosyncrasique, iDILI). L’iDILI se subdivise en formes immuno-médiées (allergiques) ou non immuno-médiées (non allergiques), ces dernières résultant de dommages cellulaires causés par l’accumulation de métabolites dans les hépatocytes. L’apparition de ces lésions dépend de mécanismes physiopathologiques complexes, influencés par des facteurs génétiques, environnementaux et individuels.
Outre le paracétamol, inducteur bien connu d’hépatotoxicité dose-dépendante, les médicaments les plus souvent impliqués sont les psychotropes et les antibiotiques. Mais plus de 1 100 molécules, incluant une centaine de plantes médicinales et compléments alimentaires, sont identifiées comme causes potentielles de DILI. Plus récemment, les inhibiteurs de points de contrôle immunitaire ont aussi été associés à une hausse des cas d’iDILI.
Si la majorité des patients guérissent dans les six mois suivant l’arrêt du traitement, environ 30 % développent une maladie hépatique chronique, nécessitent une transplantation ou décèdent.
La prédiction du DILI est donc un enjeu capital pour le développement de nouvelles thérapies.
L’évaluation préclinique de la sécurité des médicaments est un exercice complexe. Les différences inter-espèces dans le métabolisme hépatique entraînent parfois un manque d’efficacité ou une toxicité imprévue lors des phases cliniques, malgré des résultats prometteurs chez l’animal. Le fait que le DILI reste responsable de 30 % des abandons de candidats pharmaceutiques illustre l’urgence de modèles plus prédictifs.
La toxicité dose-dépendante est généralement bien anticipée lors des études précliniques. En revanche, l’iDILI reste difficile à prévoir en raison de son étiologie multifactorielle, de sa dépendance aux caractéristiques individuelles et environnementales, de la latence variable des symptômes (de quelques semaines à plusieurs mois), et du faible pourcentage de patients concernés.
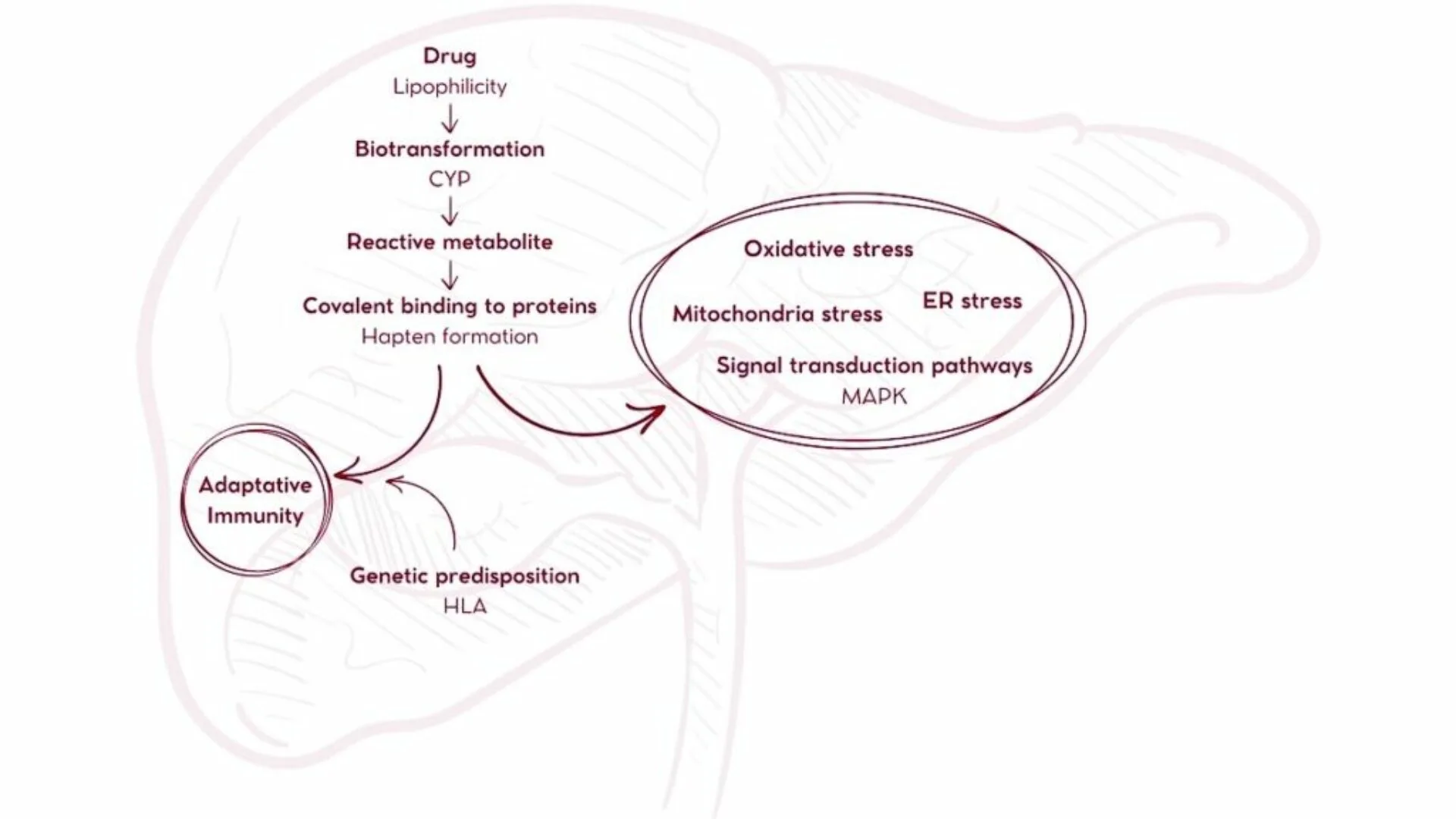
Les cas d’iDILI sont liés à la production de métabolites réactifs lors du métabolisme des médicaments, produits par le système enzymatique cytochrome P450 (CYP). Ces sous-produits peuvent activer le système immunitaire en se fixant aux protéines (haptenisation), devenant alors de nouveaux antigènes.
Évaluer la métabolisation par les CYP est donc crucial.
Hépatocytes humains primaires : modèle idéal mais limité par leur courte durée de vie, la perte rapide de fonction, leur coût et leur rareté.
Lignes cellulaires immortalisées (HepaRG, HepG2) : utilisées classiquement, mais ne reflètent pas fidèlement le foie humain sain.
Primates non-humains : proches de l’Homme mais posant des problèmes éthiques et financiers.
Rongeurs : pratiques et économiques, mais présentant de fortes différences inter-espèces.
Ces divergences peuvent entraîner deux erreurs critiques :
Faux négatif : absence de détection d’une toxicité réelle (ex. FIAU – Fialuridine, ayant causé des décès en phase clinique).
Faux positif : détection d’une toxicité inexistante chez l’Homme (ex. furosémide, sûr chez l’Homme mais toxique chez la souris).
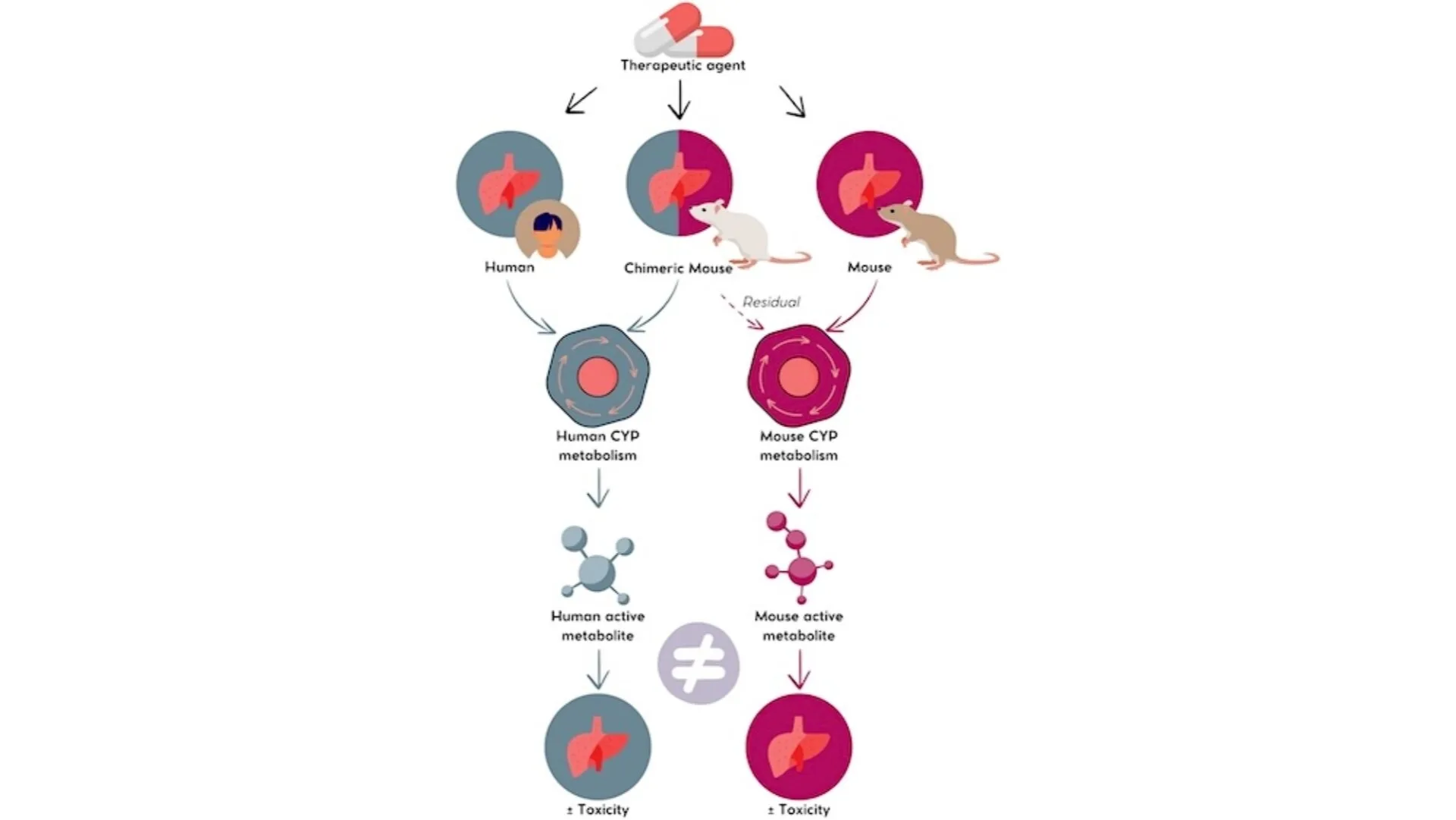
Ces deux exemples emblématiques (FIAU et furosémide) ont été correctement prédits avec des souris chimériques à foie humanisé.
Furosémide : métabolite toxique détecté uniquement chez les souris classiques, pas chez les souris hu-liver.
FIAU : toxicité uniquement observée chez les souris hu-liver, reflétant fidèlement la réponse humaine.
Ce modèle permet de mieux anticiper la toxicité hépatique, en intégrant l’activité enzymatique CYP humaine et en produisant des profils métaboliques proches de la réalité clinique.
De plus, les modèles double humanisés (hépatocytes + système immunitaire humain) ouvrent la voie à des études encore plus complètes, notamment pour l’évaluation des immunothérapies.
Les souris humanisées représentent une plateforme préclinique avancée pour :
améliorer la prédiction du DILI et de l’iDILI,
mieux comprendre les mécanismes physiopathologiques,
développer de nouvelles stratégies de gestion,
et combler le besoin urgent d’antidotes spécifiques.
Ces modèles permettent de franchir une étape décisive vers des médicaments plus sûrs et plus efficaces.