- Blog
14/08/2025
Les souris, espèce la plus utilisée à des fins scientifiques, sont des êtres sensibles et leurs conditions de vie impactent leur bien-être.
Toutes les conditions d’hébergement et de manipulation des souris de laboratoire sont intrinsèquement stressantes pour ces animaux. Ceci en raison de la manipulation, de la contention, des procédures invasives et douloureuses, des environnements non naturels, de l’inconfort social, du nettoyage des cages, etc. (Bailey, 2018).
Dans les hébergements SPF et SOPF (Specific Pathogen Free / Specific and Oportunistic Pathogen Free), les exigences sanitaires augmentent les sources de stress :
Ce premier article porte spécifiquement sur l’impact des paramètres du macro-environnement sur le bien-être des souris de laboratoire hébergées en condition SPF ou SOPF.
Un second article permettra d’aller un peu plus loin en s’intéressant aux éléments modulateurs de ces paramètres primaires.
Macro-environnement vs micro-environnement : quelle différence ?
Le macro-environnement correspond à la salle d’hébergement des animaux. Il se distingue du micro-environnement qui correspond aux cages (pour en savoir davantage sur comment vivent les souris de laboratoire, consultez ce blog).
Les paramètres environnementaux à contrôler selon les directives européennes
Conformément aux directives de 1986 et 2010 (European Community Council, 1986; European parliament and of the council of 22 September 2010 on the protection of animals used for scientific purposes, 2010), les paramètres environnementaux suivants doivent être contrôlés : température, humidité, luminosité et cycle lumineux, ventilation, bruit, vibrations. La ventilation n’est pas considérée ici comme un paramètre primaire parce que le taux de renouvellement de l’air et les pressions relatives sont des modulateurs d’autres paramètres environnementaux comme la température et l’humidité.

Une température de salle adaptée à l’humain, pas aux souris
La directive européenne demande de surveiller quotidiennement la température, qui doit être maintenue entre 20 et 24 °C. Cette fourchette de température correspond plutôt à la thermoneutralité (plage de température qui nécessite le moins de dépense d’énergie) des humains, mais pas à celle des souris (qui est comprise entre 29 et 32°C). Par conséquent, les souris doivent dépenser de l’énergie pour maintenir leur température corporelle.
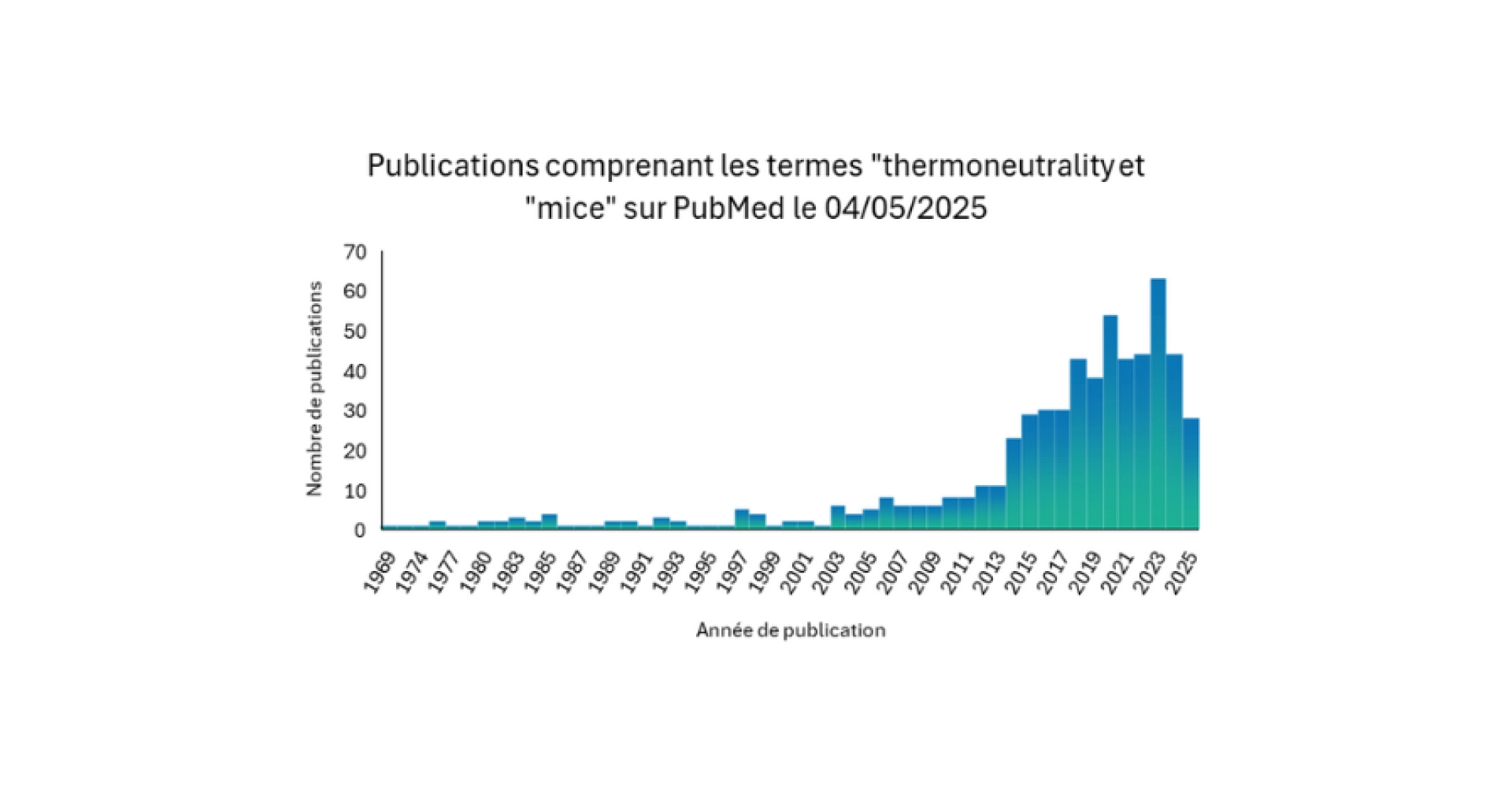
La considération de la thermoneutralité des souris est relativement récente (voir Figure 1).
Figure 1 : Résultat d’une recherche PubMed avec les termes (dans « all fields ») « thermoneutrality » et « mice » et l’application du filtre « Other Animals » réalisée le 04/11/2025.
Conséquences physiologiques et scientifiques
L’impact de la température sur de nombreuses fonctions et paramètres physiologiques et pathophysiologiques (exemples : microbiote, inflammation, système cardiovasculaire, adiposité, densité osseuse, athérosclérose, croissance tumorale, Nonalcoholic fatty liver disease (NAFLD), …) est un sujet d’actualité.
Des webinaires (par exemple, le replay de celui organisé par le FC3R « Facteurs extrinsèques en recherche sur l’animal : température et thermoneutralité » est disponible ici) et des revues scientifiques pointent l’importance de considérer ce biais dans l’utilisation de ces animaux pour modéliser et étudier des pathologies humaines (Fischer et al., 2018; Ganeshan & Chawla, 2017; Gordon, 2017; James et al., 2022; Repasky et al., 2024).
Solutions pour réduire le stress thermique des souris
De plus en plus d’éléments soulignent l’importance, pour améliorer la translationalité des études utilisant des souris, d’héberger ces animaux autour de 30°C.
Une des solutions est donc d’augmenter la température dans les salles d’hébergement. Mais le bien-être du personnel doit également être pris en compte. Dans les animaleries SPF / SOPF, les exigences sanitaires nécessitent souvent l’utilisation d’EPI couvrants qui augmentent la température ressentie par le personnel. Encore plus que dans les animaleries conventionnelles, cette solution d’augmenter la température dans les salles d’hébergement n’est pas privilégiée.
L’enrichissement des souris, notamment les éléments permettant de faire un nid, permet aux animaux de mieux réguler leur température et réduit l’aversion pour les environnements plus froids (Garner et al., 2011, 2018; Hylander & Repasky, 2016).
En plus des éléments permettant aux souris de faire un nid plus chaud (enrichissements de type coton / papier kraft / abris), l’hébergement en groupes sociaux stables aide à la thermorégulation. Les souris vont pouvoir dormir en groupe et limiter ainsi le stress thermique.
Des portoirs chauffants peuvent également être une solution permettant d’héberger les souris dans leur zone de thermoneutralité sans augmenter la température de la salle d’hébergement pour le confort du personnel. Ces portoirs chauffants ont d’abord été développés pour améliorer le rétablissement en post-chirurgie, ils peuvent être aussi utilisés pour les études qui sont particulièrement impactés par le stress thermique.
Plusieurs modèles existent : des armoires chauffantes (un exemple) dans lesquelles les cages des souris sont placées ; des portoirs plus classiques qui intègrent des plaques chauffantes sous chaque cage (un exemple).
Paramètres à surveiller
L’humidité relative de la salle d’hébergement doit être surveillée quotidiennement (European parliament and of the council of 22 September 2010 on the protection of animals used for scientific purposes, 2010) et être comprise entre 40 et 60% (Canadian Council on Animal Care, 2019) / maintenue à 55+/-10% (European Community Council, 1986).
L’humidité relative dans les cages dépend de celle de la pièce, mais aussi de nombreux paramètres comme le nombre d’animaux dans la cage, la fréquence de change, le type et la quantité d’enrichissements et de litière, le type de cage, la position de la cage sur le portoir, la fréquence de ventilation (Canadian Council on Animal Care, 2019).
Risques d’une humidité trop basse ou trop élevée
Un trop faible taux d’humidité peut engendrer de la déshydratation chez les animaux jeunes (Hessler & Leary, 2002) et altérer les sécrétions lacrymales, ce qui peut générer des signes cliniques liés à une sècheresse oculaire (Barabino et al., 2007). Des infections respiratoires peuvent également apparaitre (Recordati et al., 2015).
A l’inverse, un taux trop élevé empêche les animaux de se thermoréguler et génère une augmentation des taux d’ammoniac (liés à une prolifération bactérienne) (Canadian Council on Animal Care, 2019).
Solutions pour maîtriser l’humidité
L’humidité relative doit être surveillée constamment, ce qui est généralement fait au niveau de la salle d’hébergement. Puisque de nombreux facteurs modifient l’humidité au sein de la cage, il faut rester attentif à l’apparition de signes cliniques (ex : conjonctivites ; problèmes respiratoires).
Pour surveiller l’humidité au sein des cages, les portoirs ventilés donnent une indication générale puisque le taux d’humidité dans l’air sortant est mesuré et normalement affiché. Mais l’emplacement des cages au sein du portoir peut faire varier les taux d’humidité. Il est possible d’utiliser des stations météorologiques miniatures qui peuvent être installées dans les cages (dans la mangeoire pour une mesure sur du moyen terme ; directement sur la litière pour une mesure ponctuelle). Ces mesures précises peuvent apporter des éléments de réponses à l’apparition de signes cliniques.
Si des taux d’ammoniac sont trop élevés dans les cages (plus de 25/50 ppm selon les normes sélectionnées (Rosenbaum et al., 2010; Silverman et al., 2009)) il est possible de descendre à 30% d’humidité pour moduler le taux d’ammoniac, ce qui reste acceptable pour les souris (Canadian Council on Animal Care, 2019).
Pourquoi la lumière est-elle un facteur critique ?
La luminosité, mesurée classiquement en lux, et les cycles lumineux sont d’autres paramètres essentiels à contrôler dans les salles d’hébergement puisqu’ils peuvent impacter la physiologie, la morphologie et le comportement des animaux (Committee for the Update of the Guide for the Care and Use of Laboratory Animals et al., 2011).
Le guide utilisé par l’AAALAC (pour en savoir plus sur l’accréditation AAALAC et le rôle de cette association internationale, consultez ce blog) indique que les animaux sensibles à la luminosité devraient être hébergés a une intensité lumineuse de 130 à 320 lux mesurés au niveau des cages (Committee for the Update of the Guide for the Care and Use of Laboratory Animals et al., 2011).
Le cycle lumineux est le plus souvent découpé en deux périodes identiques (12h:12h). Les souris étant des animaux nocturnes, leur phase d’éveil correspond à la période de nuit et la phase de sommeil à la période de jour. Pour faciliter le travail des employés, la phase d’éclairage est souvent en journée. Les animaux vont donc être dérangés, observés et manipulés durant leur phase de sommeil.
Risques d’une luminosité inadéquate
Une luminosité trop importante peut abimer la rétine des animaux, notamment les souches albinos. L’intensité lumineuse suffisante pour engendrer des dégâts physiologiques est dépendante de plusieurs facteurs comme la luminosité d’hébergement habituelle des animaux, l’âge et la souche.
Il n’existe pas de seuil maximal consensuel à respecter dans les salles d’hébergement. Les rongeurs montrent une préférence pour les luminosités faibles jusqu’à 25 lux (Committee for the Update of the Guide for the Care and Use of Laboratory Animals et al., 2011). Mais ces niveaux de luminosité ne permettent pas au personnel de travailler sereinement, et gênent l’observation des animaux dans leur cage. Il faut donc établir la luminosité la plus basse permettant au personnel de travailler.
Solutions d’adaptation lumineuse pour les souris
Si la luminosité ne peut pas être diminuée à cause de l’organisation de la pièce ou de tout autre facteur, il est possible d’utiliser des enrichissements (comme des tunnels opaques) qui permettent aux animaux de se soustraire à la lumière (Committee for the Update of the Guide for the Care and Use of Laboratory Animals et al., 2011).
À TransCure bioServices, le comité bien-être animal a déterminé un seuil de 60 lux à ne pas dépasser au niveau des cages. Un audit annuel permet de s’assurer du respect de cette consigne.
Lorsque la manipulation et l’observation des animaux durant leur phase de sommeil est trop contraignante pour répondre à l’objectif scientifique (ex : certaines études comportementales nécessitent de travailler pendant la phase d’éveil des animaux), le cycle lumineux peut être inversé. Ainsi, les souris sont hébergées dans une pièce sombre le jour, ce qui permet de les manipuler durant leur phase d’éveil (voir schéma ci-dessous).
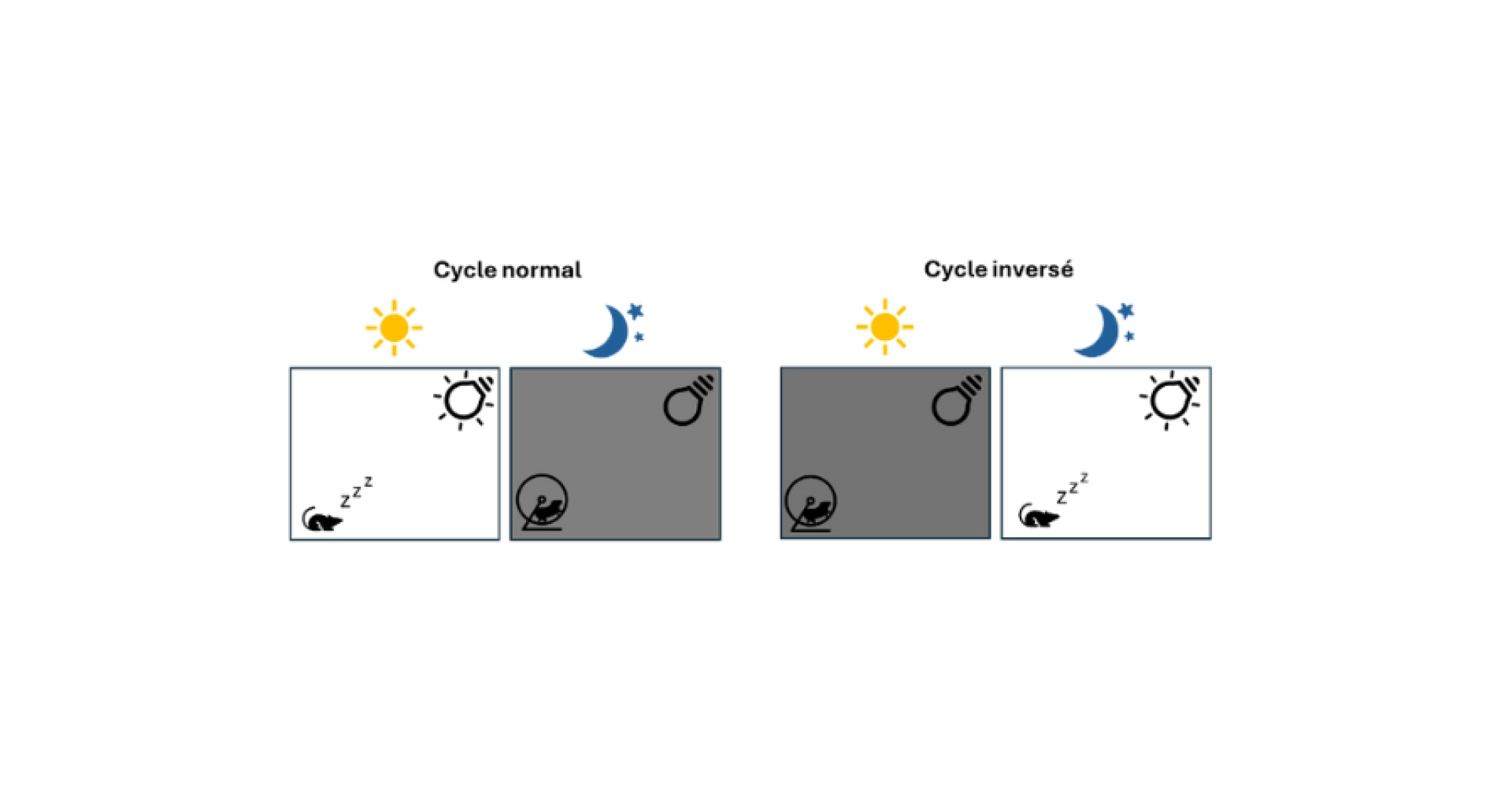
Pour que le personnel puisse travailler sur des plages horaires classiques, une lumière rouge peut être utilisée. Cependant, la lumière rouge impacte l’activité des souris et ne devrait pas remplacer la phase nocturne (Hofstetter et al., 2005; Zhang et al., 2017).
Pourquoi le bruit est-il un facteur de stress majeur ?
Le bruit fait partie des facteurs extrinsèques majeurs pouvant impacter le bien-être des souris en animalerie. Cela est d’autant plus important à prendre en compte que le contexte de vie des souris ne leur permet pas de se soustraire à cette nuisance (la mise en place de mécanismes de résilience est donc compromise) et que ces animaux nocturnes subissent davantage de nuisance durant leur phase de sommeil.
Depuis longtemps, la communauté scientifique a montré que le bruit peut affecter de nombreux paramètres comportementaux et physiologiques, ce qui peut impacter les résultats scientifiques. Soumettre des souris de manière prolongée à un bruit important, et dans leur spectre sonore, peut notamment avoir des effets tératogènes et altérer la reproduction (Peterson, 1980).
Bonnes pratiques
Le niveau sonore des salles d’hébergement devrait être limité au maximum, plus particulièrement les bruits aigus (voire suraigus) comme les sifflements générés par des moteurs défectueux ou les rires féminins.
Ci-dessous, une illustration des liens entre le cortex auditif et d’autres structures cérébrales impactant de nombreuses fonctions physiologiques.
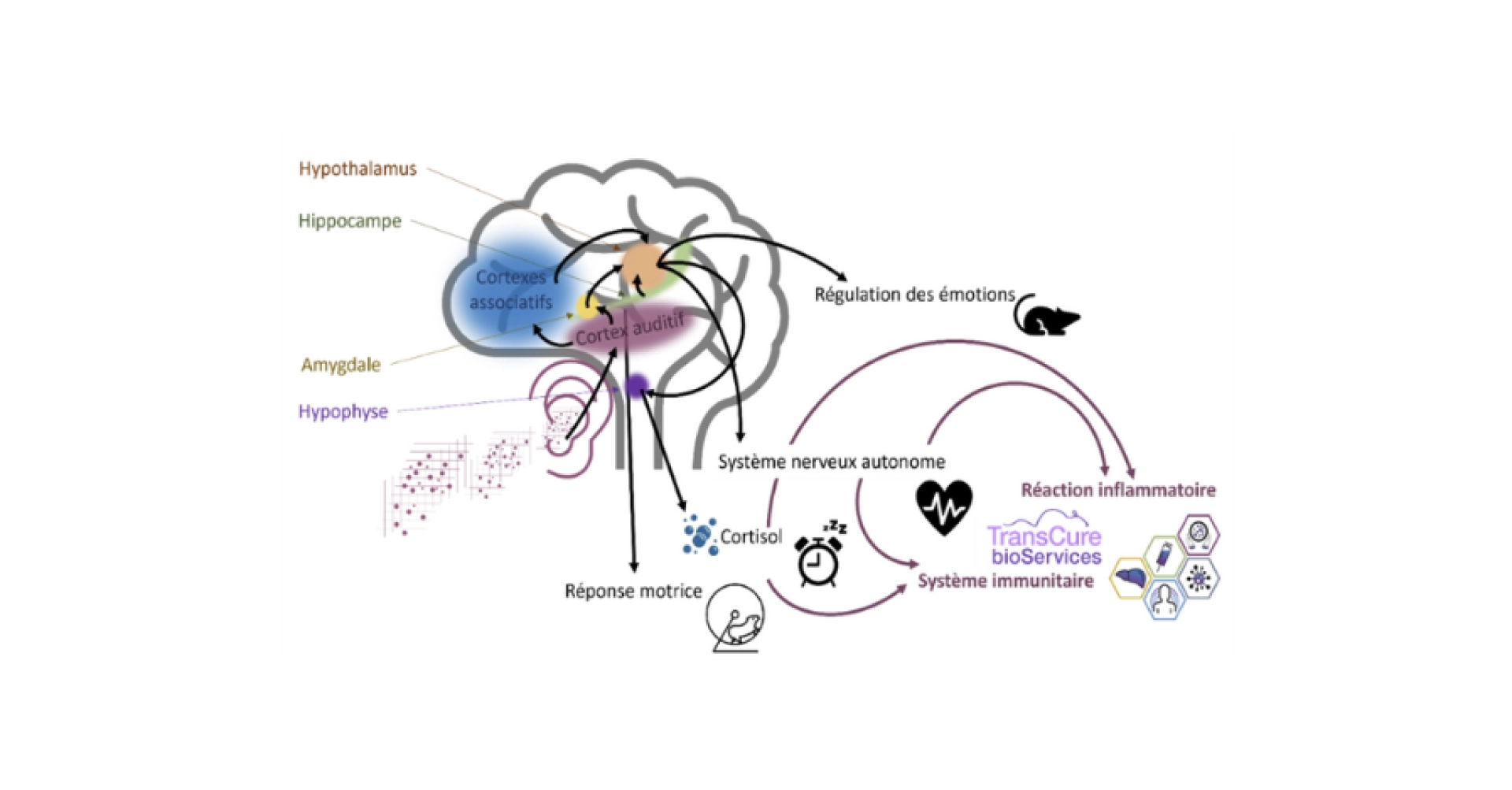
Pour davantage d’information à ce sujet, vous pouvez consulter l’article qui y est dédié : Impact du bruit dans les salles d’hébergement des souris de laboratoire.
Mesures et seuils recommandés
Il existe différentes unités pour quantifier les vibrations : avec l’amplitude par RMS (root mean square) ; ou avec l’accélération en g ou en m/s², qui peut être mesurée sur les 3 axes ou seulement l’axe vertical. Les outils de mesure doivent prendre en compte une gamme adéquate de fréquences (2Hz – 500Hz).
Les vibrations sont considérées comme une source de stress pour les animaux de laboratoire et un biais pouvant altérer les résultats expérimentaux (Norton et al., 2011; Reynolds et al., 2018).
Les vibrations sont en partie inhérentes à chaque installation et conditions de logement des animaux et peuvent provenir de l’intérieur (équipements divers comme les portoirs ventilés) ou de l’extérieur de l’animalerie (des travaux de voirie par exemple).
Le seuil de 25 milli-g basé sur une revue de la littérature a été proposé en 2020, notamment pour l’impact des vibrations sur les taux de corticostérone (hormone du stress) (Turner, 2020). Les recommandations indiquent de les limiter au maximum (Fawcett, 2012).
Effets d’une exposition excessive
Des vibrations excessives ont été associées à des changements biochimiques et reproducteurs chez les animaux de laboratoire (Briese et al., 1984; Carman et al., 2007). Des effets sur le comportement et les taux de corticostérone ont été montrés chez des souris avec des vibrations de 25 milli-g. Le sommeil des animaux peut également être impacté, mais aussi des paramètres physiologiques notamment au niveau du système cardiovasculaire (Turner, 2020).
Tous ces effets, s’ils sont ignorés et non quantifiés, peuvent devenir un biais scientifique.
Solutions pour réduire les vibrations
La première étape est de concevoir une animalerie en prenant en compte les sources de vibrations internes (liées aux équipements) pour les dissocier au maximum des zones d’hébergement.
Bien entendu, la conception des locaux ou leur aménagement n’est pas toujours totalement exempte de contraintes. La sélection des équipements peut être un autre moyen de réduire les vibrations, et donc leur impact sur le bien-être des animaux et les résultats scientifiques.
Certaines vibrations ne peuvent pas être évitées, c’est par exemple le cas lorsque la source est extérieure à l’animalerie ou que des travaux sont nécessaires. Dans ce cas, des éléments isolants peuvent être utilisés (voir l’image d’un tapis anti-vibration ci-contre). Soit pour réduire la transmission des vibrations à la source (sous une centrifugeuse par exemple), soit pour réduire l’impact de ces vibrations sur les animaux (sous les portoirs des souris).
A TransCure bioServices, les vibrations sont mesurées régulièrement au niveau des portoirs des animaux. Des tapis anti-vibration ont été testés pour déterminer leur efficacité dans plusieurs circonstances. Ils sont placés sous les portoirs lors des phases de travaux de l’animalerie (réduction significative du temps de dépassement du seuil de 25 milli-g).
Les paramètres environnementaux sont des éléments essentiels à connaître et à surveiller. Leur impact éthique peut être important à cause de leur influence sur le stress ressenti par les animaux et de nombreux paramètres physiologiques.
Ils doivent être étroitement surveillés également pour le biais scientifique qu’ils peuvent constituer. En effet, les effets physiologiques du stress ne sont plus à démontrer et expliquent le lien direct entre bien-être animal et qualité des résultats. De plus, l’exemple de l’intérêt récent de la communauté scientifique pour les questions de thermoneutralité montre l’attention qu’il faut porter à ces éléments extérieurs aux études.
Pour en savoir plus sur les conditions d’hébergement et les pratiques de bien-être animal à TransCure bioServices, consultez nos autres articles du blog.
Bailey, J. (2018). Does the stress of laboratory life and experimentation on animals adversely affect research data? A critical review. In ATLA Alternatives to Laboratory Animals (Vol. 46, Issue 5, pp. 291–305). FRAME. https://doi.org/10.1177/026119291804600501
Barabino, S., Rolando, M., Chen, L., & Dana, M. R. (2007). Exposure to a dry environment induces strain-specific responses in mice. Experimental Eye Research, 84(5), 973–977. https://doi.org/10.1016/J.EXER.2007.02.003
Canadian Council on Animal Care. (2019). CCAC guidelines: Mice (CCAC, Ed.; CCAC). Canadian Council of Animal Care. http://www.ccac.caACKNOWLEDGEMENTS
Committee for the Update of the Guide for the Care and Use of Laboratory Animals, Institute for Laboratory Animal Research, Division on Earth and LifeStudies, & National Research Council. (2011). Guide for the Care and Use of Laboratory Animals: Eighth Edition. In National Research Council 2011 (Ed.), Guide for the Care and Use of Laboratory Animals (8th ed.). National Academies Press. https://doi.org/10.17226/12910
European Community Council. (1986). Directive 86/609/CEE.
European parliament and of the council of 22 September 2010 on the protection of animals used for scientific purposes. (2010). Directive 2010/63/EU.
Fawcett, A. (2012). Guidelines for the Housing of Mice in Scientific Institutions.
Fischer, A. W., Cannon, B., & Nedergaard, J. (2018). Optimal housing temperatures for mice to mimic the thermal environment of humans: An experimental study. Molecular Metabolism, 7, 161–170. https://doi.org/10.1016/j.molmet.2017.10.009
Ganeshan, K., & Chawla, A. (2017). Warming the mouse to model human diseases. Nature Reviews Endocrinology 2017 13:8, 13(8), 458–465. https://doi.org/10.1038/nrendo.2017.48
Garner, J. P., Gaskill, B. N., Gordon, C. J., Pajor, E. A., Lucas, J. R., & Davis, J. K. (2018). Impact of nesting material on mouse body temperature and physiology Author’s personal copy Impact of nesting material on mouse body temperature and physiology. https://doi.org/10.1016/j.physbeh.2012.12.018
Garner, J. P., Gaskill, B. N., Rohr, S. A., Pajor, E. A., & Lucas, J. R. (2011). Working with what you’ve got: Changes in thermal preference and behavior in mice with or without nesting material Author’s personal copy Working with what you’ve got: Changes in thermal preference and behavior in mice with or without nesting material. Article in Journal of Thermal Biology. https://doi.org/10.1016/j.jtherbio.2011.02.004
Gordon, C. J. (2017). The mouse thermoregulatory system: Its impact on translating biomedical data to humans. Physiology & Behavior, 179, 55–66. https://doi.org/10.1016/J.PHYSBEH.2017.05.026
Hessler, J. R., & Leary, S. L. (2002). Design and Management of Animal Facilities. Laboratory Animal Medicine, 909–953. https://doi.org/10.1016/B978-012263951-7/50024-7
Hofstetter, J. R., Hofstetter, A. R., Hughes, A. M., & Mayeda, A. R. (2005). Intermittent long-wavelength red light increases the period of daily locomotor activity in mice. Journal of Circadian Rhythms 2005 3:1, 3(1), 1–8. https://doi.org/10.1186/1740-3391-3-8
Hylander, B. L., & Repasky, E. A. (2016). Thermoneutrality, Mice, and Cancer: A Heated Opinion. Trends in Cancer, 2(4), 166–175. https://doi.org/10.1016/j.trecan.2016.03.005
James, C. M., Olejniczak, S. H., & Repasky, E. A. (2022). How murine models of human disease and immunity are influenced by housing temperature and mild thermal stress. https://doi.org/10.1080/23328940.2022.2093561
Lovasz, R. M., Marks, D. L., Chan, B. K., & Saunders, K. E. (2020). Effects on Mouse Food Consumption after Exposure to Bedding from Sick Mice or Healthy Mice. Journal of the American Association for Laboratory Animal Science, 59(6), 687–694. https://doi.org/10.30802/AALAS-JAALAS-19-000154
Norton, J. N., Kinard, W. L., & Reynolds, R. P. (2011). Comparative Vibration Levels Perceived Among Species in a Laboratory Animal Facility. Journal of the American Association for Laboratory Animals, 50(5), 653–659.
Recordati, C., Basta, S. M., Benedetti, L., Baldin, F., Capillo, M., Scanziani, E., & Gobbi, A. (2015). Pathologic and Environmental Studies Provide New Pathogenetic Insights Into Ringtail of Laboratory Mice. Veterinary Pathology, 52(4), 700–711. https://doi.org/10.1177/0300985814556191
Repasky, E. A., Hylander, B. L., & Mohammadpour, H. (2024). Temperature matters: the potential impact of thermoregulatory mechanisms in brain–body physiology. Genes & Development, 38(17–20), 817–819. https://doi.org/10.1101/GAD.352294.124
Reynolds, R. P., Li, Y., Garner, A., & Norton, J. N. (2018). Vibration in mice: A review of comparative effects and use in translational research. In Animal Models and Experimental Medicine (Vol. 1, Issue 2, pp. 116–124). John Wiley and Sons Inc. https://doi.org/10.1002/ame2.12024
Rosenbaum, M. D., VandeWoude, S., Volckens, J., & Johnson, T. (2010). Disparities in Ammonia, Temperature, Humidity, and Airborne Particulate Matter between the Micro-and Macro environments of Mice in Individually Ventilated Caging. Journal of the American Association for Laboratory Animal Science, 49(2), 177–183. https://www.researchgate.net/publication/42767874_Disparities_in_Ammonia_Temperature_Humidity_and_Airborne_Particulate_Matter_between_the_Micro-and_Macro_environments_of_Mice_in_Individually_Ventilated_Caging
Silverman, J., Bays, D. W., & Baker, S. P. (2009). Ammonia and carbon dioxide concentrations in disposable and reusable static mouse cages. Lab Animal, 38(1).
Sterley, T. L., Baimoukhametova, D., Füzesi, T., Zurek, A. A., Daviu, N., Rasiah, N. P., Rosenegger, D., & Bains, J. S. (2018). Social transmission and buffering of synaptic changes after stress. Nature Neuroscience, 21(3), 393–403. https://doi.org/10.1038/s41593-017-0044-6
Turner, J. G. (2020). Noise and Vibration in the Vivarium: Recommendations for Developing a Measurement Plan. Journal of the American Association for Laboratory Animal Science, 59(6). https://doi.org/10.30802/AALAS-JAALAS-19-000131
Zhang, Z., Wang, H.-J., Wang, D.-R., Qu, W.-M., & Huang, Z.-L. (2017). Red light at intensities above 10lx alters sleep-wake behavior in mice. https://doi.org/10.1038/lsa.2016.231