- Blog
14/08/2025
L’utilisation d’animaux à des fins scientifiques fait l’objet d’une législation spécifique qui a évolué avec la prise en compte de la sensibilité des animaux (EUROPEAN PARLIAMENT & COUNCIL OF THE EUROPEAN UNION, 2010). Il est maintenant nécessaire et obligatoire de prendre en charge la douleur et la souffrance générées par les conditions expérimentales. Mais pour cela il faut être capable de détecter les signes de douleur et de souffrance.
On s’intéresse ici à l’espèce la plus utilisée à des fins scientifiques : la souris. Cette espèce a la particularité d’être une proie et donc d’avoir des comportements spécifiques à ce statut. Les souris de laboratoire, même si elles sont manipulées avec le plus de soin possible, considèrent les humains comme des prédateurs potentiels et adaptent leur comportement à la présence humaine. Montrer un signe de faiblesse à son prédateur est dangereux pour une proie, les souris ont donc tendance à cacher leur état (Turner et al., 2019). C’est une difficulté importante à la détection de la douleur. Malgré cela il existe plusieurs stratégies pour détecter la douleur chez la souris :
Certains signes cliniques semblent évidents, comme les vocalisations, le retrait de la zone douloureuse au toucher, une boiterie ou un grattage excessif. L’observation de ces signes doit être considéré comme la preuve d’une douleur importante et donc faire l’objet d’un traitement (soins, analgésiques) ou de l’euthanasie de l’animal pour mettre fin aux souffrances.
Des scores cliniques peuvent être utilisés pour évaluer l’état général d’un animal, une douleur et / ou une souffrance pouvant altérer cet état. Ce score consiste en une liste de signes cliniques observables ou quantifiables chez la souris, le score s’adapte aux types de recherche et aux désagréments potentiellement attendus chez les animaux utilisés. Voici une liste non exhaustive de signes pouvant être pris en compte (Committee for the Update of the Guide for the Care and Use of Laboratory Animals et al., 2011) :
Chaque signe est noté absent ou présent (avec parfois des degrés comme modérément présent et fortement présent) avec un score associé. L’addition des scores de ces signes donne une score clinique général qui peut être utilisé comme point limite.
Chez TransCure bioServices, un score clinique permettant de monitorer l’état de santé général des tous les animaux comprend 5 signes scorés de 0 à 3 ; le point limite utilisé est fixé à un score global de 7.
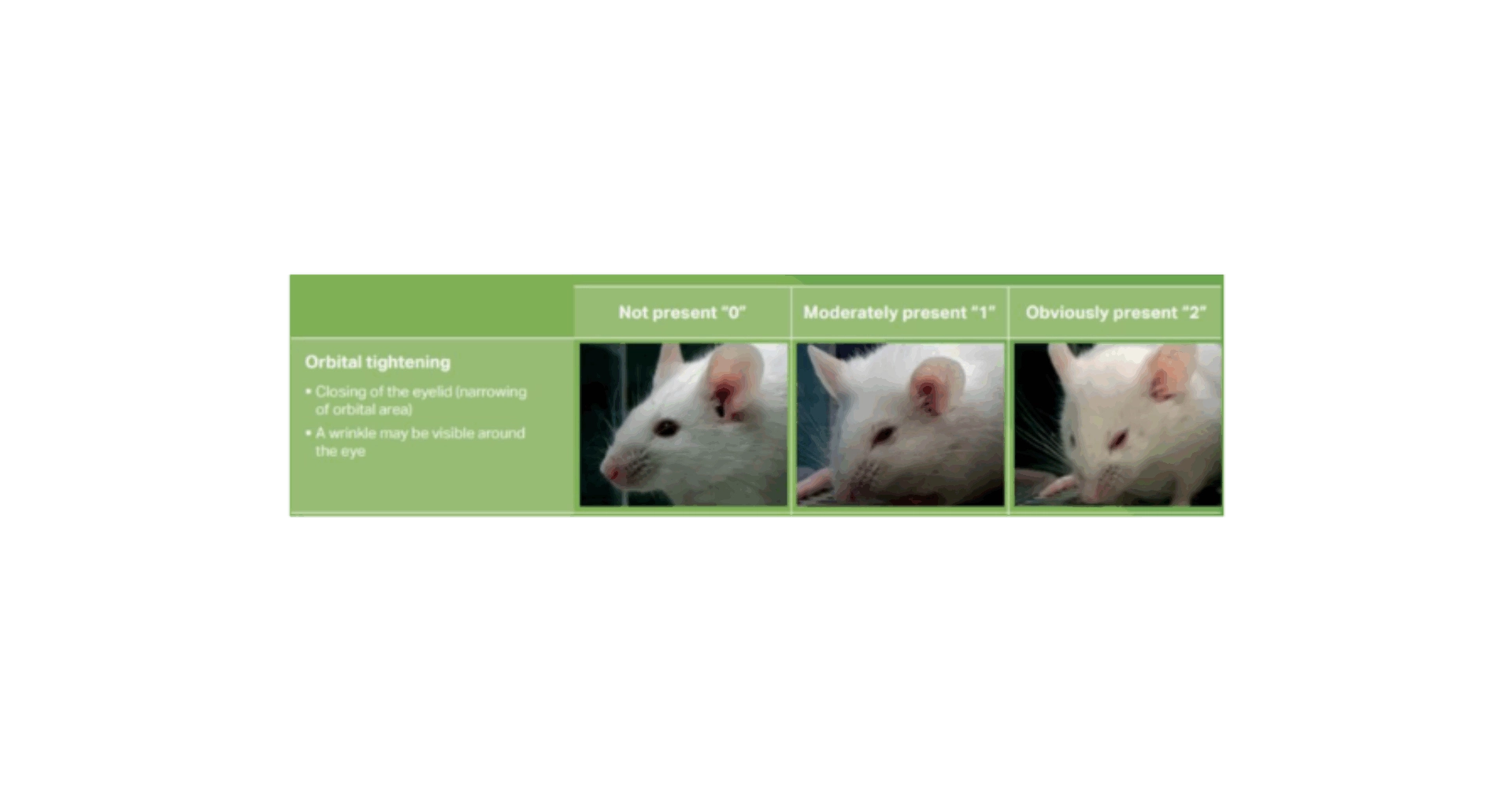
Figure 1 : Extraction du Grimace Face Scale du NC3Rs (NC3Rs, 2015)
Des mesures physiologiques associées au stress peuvent aussi être utilisées comme le taux de corticostérone (hormone liée au stress), le rythme cardiaque (plus élevé en cas de mal- être) ou le taux de glucose (Balcombe et al., 2004). Ces mesures nécessitent souvent un acte invasif comme une prise de sang bien que de nouvelles méthodes apparaissent pour mesurer la corticostérone dans les fèces, l’urine ou les poils (Ataallahi et al., 2022) ; ou encore pour mesurer le rythme cardiaque à l’aide d’un gilet non invasif (disponible actuellement pour les rats mais pas encore adapté à la souris) (Fares & Boire, 2020).
Un grattage excessif ou une prostration sont des comportements évident de gène ou de douleur qui peuvent être pris en compte dans les scores cliniques. Ces signes démontrent d’un mal être déjà avancé, d’autres signes comportementaux permettent de détecter plus précocement le stress, potentiellement en lien avec une douleur.
De nombreux tests comportementaux ont été développés chez les rongeurs de laboratoire pour étudier leur anxiété au niveau individuel. Des dispositifs variés, plus ou moins anxiogènes, sont utilisés généralement en isolant un individu durant un temps variable (généralement entre 5min et 1h) et en quantifiant certains comportements de l’animal (Durst et al., 2021).
Chez TransCure bioServices, les tests comportementaux d’anxiété sont sélectionnés parmi le large panel qu’offre la littérature pour être les moins impactant pour les souris. Les deux dispositifs sélectionnés sont l’open field et la boite noire et blanche (voir Figure 2), le protocole de test a été réduit au maximum (5min par souris) pour limiter le temps d’isolement de ces animaux sociaux.
Figure 2 : Une souris femelle dans le dispositif de la boîte noire et blanche.

Outre l’anxiété, d’autres indices sont liés au stress et à la douleur. Dans les études sur la dépression le test de préférence au sucrose est souvent utilisé pour mesurer l’anhédonie (Liu et al., 2018). Ce test nécessite normalement d’isoler les souris durant une période relativement longue (de 24h à quelques jours), pour éviter ce désagrément au souris le protocole a été adapté en interne pour obtenir des résultats non pas individuels mais par cage.
Un code des expressions faciales de douleur a été proposé en 2010 pour la souris de laboratoire, en partant du principe que de nombreux animaux sont capables d’exprimer des émotions à travers des expressions faciales (Langford et al., 2010). Ce code baptisé « the Mouse Grimace Scale » s’est démocratisé et est maintenant largement accepté et utilisé (Whittaker et al., 2021).
5 éléments d’expression faciale liée à la douleur ont été sélectionnés et doivent être notés en fonction de leur absence (score 0 ; pas de douleur) à leur présence modérée (score 1) ou intense (score 2). L’utilisation de ce score nécessite une observation sur un animal vigile, par une personne habituée au contact des souris et sur un temps suffisamment long. C’est un indice clinique de douleur important mais qui génère des différences inter-observateurs pouvant être importantes.
Malgré les difficultés de détection de la douleur chez la souris à cause de son statut de proie, plusieurs éléments ont été développés pour raffiner les méthodes en expérimentation animale. L’utilisation de plusieurs méthodes permet une évaluation plus fiable, les méthodes utilisant une évaluation subjective (le score clinique et le Grimace Face Scale) nécessitent des observateurs expérimentés et habitués au contact des souris.
En plus des difficultés de détection de la douleur, d’autre éléments freinent sa prise en charge chez la souris (Foley et al., 2019):
Pourtant, une douleur non prise en charge est un biais important en recherche et peut altérer les résultats scientifiques par l’interaction entre le stress généré par cette douleur et la physiologie de l’animal, notamment son système immunitaire (Taylor, 2019).
Pour raffiner nos méthodes dans le cadre d’utilisation d’animaux à des fins scientifiques, il faut continuer à améliorer les méthodes de détection de la douleur mais aussi réduire les freins de sa prise en charge. Utiliser des traitements analgésiques de manière préventive (sans attendre d’observer un signe de douleur, par exemple avant une chirurgie) ou en suspectant seulement une douleur (sans observer de signe de douleur, on peut considérer qu’une lésion comme une tumeur ulcérée est à minima inconfortable, certainement douloureuse) sont des avancées nécessaires qui doivent être généralisées.
À titre d’exemple, chez TransCure bioServices, une souris présentant une tumeur en phase pré-ulcérative (par exemple une rougeur sans lésion cutanée) est sous traitement analgésique.
Nos connaissances et notre prise en considération de la douleur ressentie par les animaux que nous utilisons à des fins scientifiques s’améliore au fil du temps. Nous devons poursuivre cette évolution vers un raffinement de l’ensemble de nos stratégies de gestion de la douleur chez la souris de laboratoire.
Ataallahi, M., Nejad, J. G., & Park, K.-H. (2022). Selection of appropriate biomatrices for studies of chronic stress in animals: a review. Journal of Animal Science and Technology, 64(4), 621–639. https://doi.org/10.5187/jast.2022.e38
Balcombe, J. P., Barnard, N. D., & Sandusky, C. (2004). Laboratory routines cause animal stress. Journal of the American Association for Laboratory Animal Science, 43(6), 42–51.
Committee for the Update of the Guide for the Care and Use of Laboratory Animals, Institute for Laboratory Animal Research, Division on Earth and LifeStudies, & National Research Council. (2011).
Guide for the Care and Use of Laboratory Animals: Eighth Edition. In National Research Council 2011 (Ed.), Guide for the Care and Use of Laboratory Animals (8th ed.). National Academies Press. https://doi.org/10.17226/12910
Durst, M. S., Arras, M., Palme, R., Talbot, S. R., & Jirkof, P. (2021). Lidocaine and bupivacaine as part of multimodal pain management in a C57BL/6J laparotomy mouse model. Scientific Reports, 11(1). https://doi.org/10.1038/s41598-021-90331-2
EUROPEAN PARLIAMENT, & COUNCIL OF THE EUROPEAN UNION. (2010). DIRECTIVE 2010/63/EU.
Fares, R. P., & Boire, A. (2020). Simultaneous non-invasive telemetric electrocardiogram and
respiratory measurement with a connected jacket (DECRO system) in rats. Research Square.
https://doi.org/10.21203/rs.3.pex-860/v1
Foley, P. L., Kendall, L. V., & Turner, P. V. (2019). Clinical Management of Pain in Rodents. In Comparative Medicine (Vol. 69, Issue 6, pp. 468–489). American Association for Laboratory Animal Science. https://doi.org/10.30802/AALAS-CM-19-000048
Julio-Pieper, M., O’Mahony, C. M., Clarke, G., Bravo, J. A., Dinan, T. G., & Cryan, J. F. (2012). Chronic stress- induced alterations in mouse colonic 5-HT and defecation responses are strain dependent. Stress, 15(2), 218–226. https://doi.org/10.3109/10253890.2011.607524
Langford, D. J., Bailey, A. L., Chanda, M. L., Clarke, S. E., Drummond, T. E., Echols, S., Glick, S., Ingrao, J., Klassen-Ross, T., Lacroix-Fralish, M. L., Matsumiya, L., Sorge, R. E., Sotocinal, S. G., Tabaka, J. M., Wong, D., Van Den Maagdenberg, A. M. J. M., Ferrari, M. D., Craig, K. D., & Mogil, J. S. (2010). Coding of facial expressions of pain in the laboratory mouse. Nature Methods, 7(6), 447–449. https://doi.org/10.1038/nmeth.1455
Liu, M. Y., Yin, C. Y., Zhu, L. J., Zhu, X. H., Xu, C., Luo, C. X., Chen, H., Zhu, D. Y., & Zhou, Q. G. (2018). Sucrose preference test for measurement of stress-induced anhedonia in mice. Nature Protocols, 13(7), 1686–1698. https://doi.org/10.1038/s41596-018-0011-z
Taylor, D. K. (2019). Influence of Pain and Analgesia on Cancer Research Studies. In Comparative Medicine (Vol. 69, Issue 6, pp. 501–509). American Association for Laboratory Animal Science. https://doi.org/10.30802/AALAS-CM-19-000002
Turner, P. V., Pang, D. S. J., & Lofgren, J. L. S. (2019). A Review of Pain Assessment Methods in Laboratory Rodents. In Comparative Medicine (Vol. 69, Issue 6, pp. 451–467). American Association for Laboratory Animal Science. https://doi.org/10.30802/AALAS-CM-19-000042
Whittaker, A. L., Liu, Y., & Barker, T. H. (2021). Methods used and application of the mouse grimace scale in biomedical research 10 years on: A scoping review. In Animals (Vol. 11, Issue 3, pp. 1–27). MDPI AG. https://doi.org/10.3390/ani11030673
Zhang, C. Y., Peng, X. X., Shao, H. Q., Li, X. Y., Wu, Y., & Tan, Z. J. (2021). Gut Microbiota Comparison Between Intestinal Contents and Mucosa in Mice With Repeated Stress-Related Diarrhea Provides Novel Insight. Frontiers in Microbiology, 12. https://doi.org/10.3389/fmicb.2021.626691