- Blog
14/08/2025
Il est souvent difficile de distinguer une souris blanche d’une autre lorsqu’on n’est pas familiarisé avec ces animaux. Avec de l’expérience, il est possible de remarquer des différences subtiles telles que la longueur du museau, le tempérament ou encore reconnaître une souris spécifique dans une cage avec ses congénères. Cependant, ces caractéristiques ne suffisent pas aux exigences de la recherche scientifique, qui nécessite un suivi individuel des animaux utilisés. Les souris sont des mammifères qui présentent des similitudes physiologiques avec les humains. Par conséquent, elles sont toutes différentes et réagissent de manière unique à des situations spécifiques, des maladies et des traitements. C’est pourquoi il est absolument nécessaire de toujours savoir qui est qui : chaque souris doit être clairement identifiée afin de lui administrer la dose appropriée de médicament en fonction de son poids, par exemple.
En 2019, 9 132 775 animaux ont été utilisés à des fins scientifiques en Union Européenne, dont 87% de souris.
Au cours des dernières décennies, le point de vue de la société sur les animaux et les connaissances scientifiques sur leur physiologie ont considérablement évolués. Aujourd’hui considérés comme des êtres sensibles, leur bien-être se doit d’être pris en compte. Les chercheurs tiennent compte de ces avancées pour leurs recherches en général et l’identification en particulier. Le choix d’une méthode d’identification va donc placer le bien-être au cœur de sa réflexion, tout comme les contraintes de l’espèce, sa fiabilité et son coût.
Les méthodes d’identification peuvent être permanentes ou temporaires, en fonction de la question scientifique à résoudre. Par exemple, si les chercheurs n’ont besoin de reconnaître les souris que pendant une semaine, ils peuvent utiliser un marqueur pour identifier les souris avec des traits sur la queue. Cela est facile à réaliser et non invasif, mais étant donné que les souris sont des animaux très propres, elles se nettoient et il est nécessaire de refaire régulièrement le marquage.
Pour les projets scientifiques qui nécessitent de garder les souris plusieurs mois, les chercheurs vont se tourner vers des méthodes d’identification permanentes.
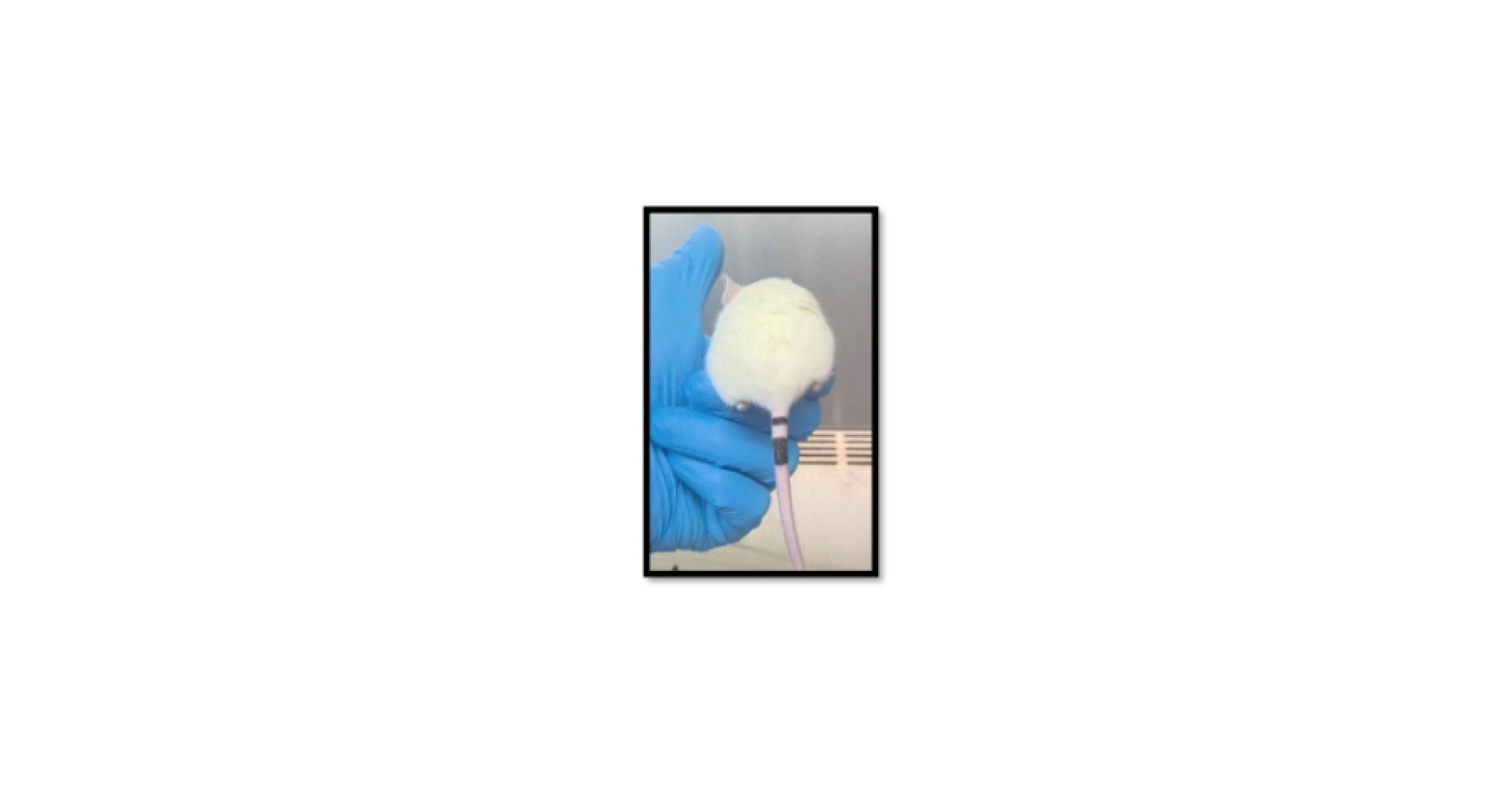
Le « toe clipping » et le « ear notching » consistent à prélever respectivement des parties des orteils ou des oreilles des souris, en suivant un code permettant de les identifier. Même s’il est important de rappeler que les souris guérissent très rapidement et que la douleur causée par ces méthodes est normalement de courte durée, une gêne peut persister après la cicatrisation, en particulier avec le « toe clipping ».
Actuellement, ces méthodes invasives sont déconseillées par les guides d’utilisation des animaux pour la recherche. Elles sont de moins en moins employées et des méthodes d’analgésie ou d’anesthésie doivent être envisagées.
Figure 1 : Ear notching for identification in mice / Animals in science (queensu.ca)
Parmi les autres méthodes d’identification, la pose de boucles d’oreilles et le tatouage sont assez courantes. L’utilisation d’analgésiques lors de ces opérations est recommandée. Cependant, ces deux méthodes présentent des inconvénients essentiellement liés à la petite taille des souris (qui font généralement moins de 20 grammes). Par conséquent, une grande minutie et une formation adéquate sont nécessaires pour garantir le bien-être optimal de l’animal.
L’utilisation de puces sous-cutanées, similaires à celles utilisées pour les chiens ou les chats domestiques, est désormais considérée comme l’une des meilleures méthodes d’identification (elle fait aussi partie des plus chères). Il suffit de scanner l’animal pour lire son identité sur le lecteur. L’insertion de la puce se fait entre les omoplates par une injection sous-cutanée qui peut être réalisée sous anesthésie générale.
À TransCure bioServices, c’est ce dernier choix qui a été sélectionné, chaque souris est identifiée au bout de quelques jours d’habituation à son nouvel environnement par l’implantation d’une puce sous cutanée sous anesthésie générale.
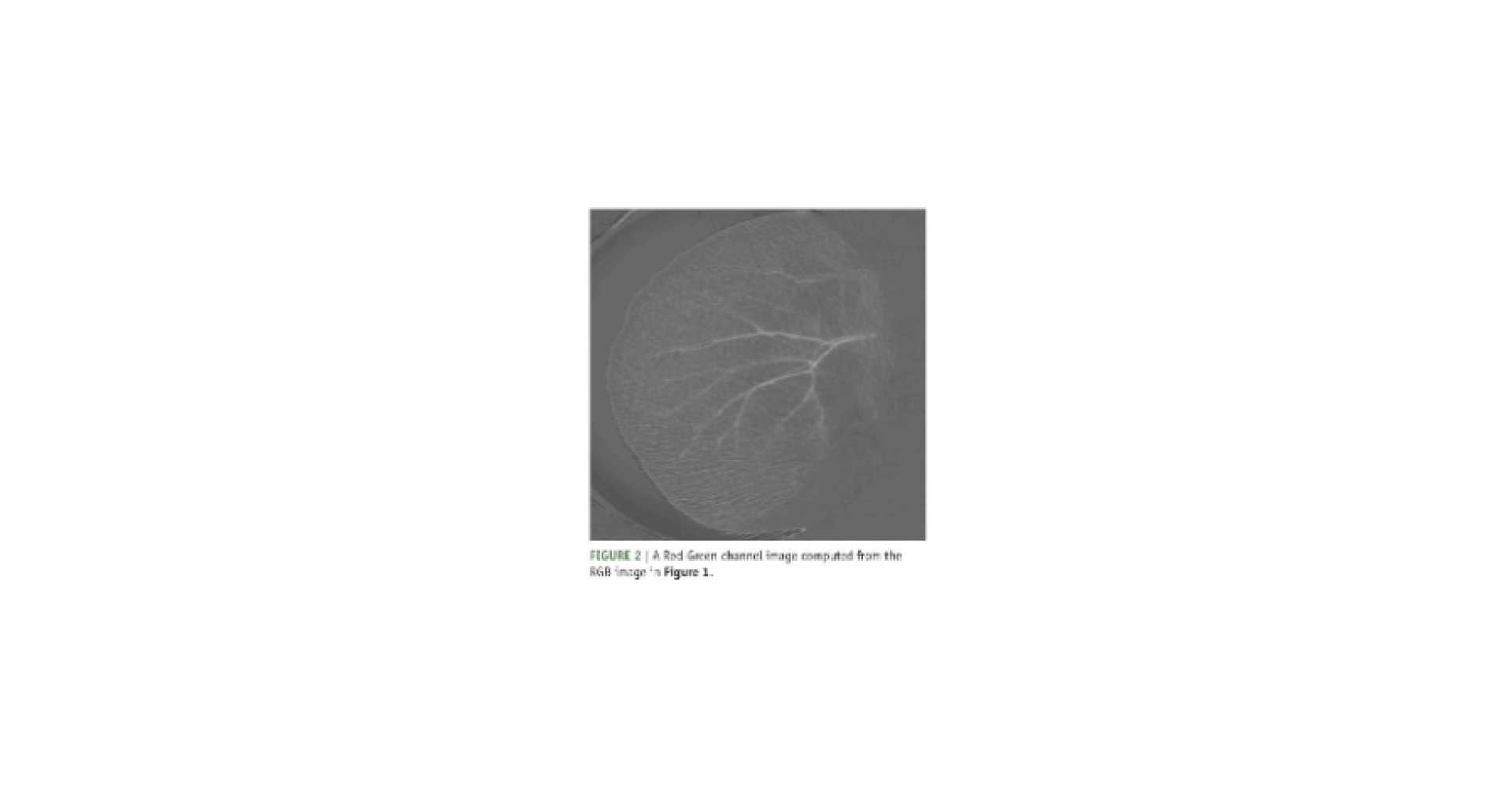
Les méthodes existantes peuvent toujours être améliorées pour diminuer l’inconfort potentiellement ressenti par les animaux. Par exemple, des analgésiques locaux peuvent être utilisés avant un tatouage. De nouvelles méthodes d’identification sont en cours de développement, avec des résultats variables. Par exemple, une méthode d’identification non invasive utilise une approche biométrique en analysant les vaisseaux sanguins visibles dans
les oreilles des souris, qui sont permanents et propres à chaque individu (voir ci-contre).
Représentation des vaisseaux sanguins de l’oreille d’une souris pour l’identification biométrique (Cameron et al. 2007)
D’autres méthodes innovantes peuvent également être citées, comme les micropuces « p-Chip » (qui commencent à être utilisées), implantées dans l’oreille ou dans la queue des souris ; ou encore les micro-tatouages luminescents LMT.
En conclusion, les méthodes d’identification des souris en expérimentation animale ont considérablement évolué ces dernières années. Le bien-être animal est une priorité et doit être systématiquement pris en compte lors du choix des méthodes. Les années à venir seront certainement riches en nouvelles innovations dans ce domaine, afin d’améliorer continuellement nos pratiques et de respecter les animaux utilisés à des fins scientifiques.
Cameron, J., Jacobson, C., Nilsson, K., & Rögnvaldsson, T. (2007). A biometric approach to
laboratory rodent identification. Lab Animal, 36(3). www.labanimal.com
Committee for the Update of the Guide for the Care and Use of Laboratory Animals, Institute for Laboratory Animal Research, Division on Earth and LifeStudies, & National Research Council. (2011). Guide for the Care and Use of Laboratory Animals: Eighth Edition. In National Research Council 2011 (Ed.), Guide for the Care and Use of Laboratory Animals (8th ed.). National Academies Press. https://doi.org/10.17226/12910
Dahlborn, K., Bugnon, P., Nevalainen, T., Raspa, M., Verbost, P., & Spangenberg, E. (2013). Report of the federation of european laboratory animal science associations working group on
animal identification. Laboratory Animals, 47(1), 2– 11. https://doi.org/10.1177/002367712473290
Donovan, J., & Brown, P. (2006). Animal Identification. In Care and Handling of Laboratory
Animals.
Kasanen, I. H. E., Voipio, H. M., Leskinen, H., Luodonpää, M., & Nevalainen, T. O. (2011). Comparison of ear tattoo, ear notching and microtattoo in rats undergoing cardiovascular telemetry. Laboratory Animals, 45(3), 154–159. https://doi.org/10.1258/la.2011.010113
Keating, S. C. J., Thomas, A. A., Flecknell, P. A., & Leach, M. C. (2012). Evaluation of EMLA Cream for Preventing Pain during Tattooing of Rabbits: Changes in Physiological, Behavioural and Facial Expression Responses. PLoS ONE, 7(9). https://doi.org/10.1371/journal.pone.0044437
Leslie, E., Hernández-Jover, M., Newman, R., & Holyoake, P. (2010). Assessment of acute pain
experienced by piglets from ear tagging, ear notching and intraperitoneal injectable transponders. Applied Animal Behaviour Science, 127(3–4), 86–95. https://doi.org/10.1016/j.applanim.2010.09.006
Mormede, P., Guy, N., Médale, F., Nivet-Antoine, V., Tarpin, M., Gonin, P., Picavet, S., Mary, V., Duclaux, S., Ghaleh, B., Behar-Cohen, F., Dudoignon, N., Desfontis, J.-C., Picavet, E., Bourg, D., Desmoulin-Canselier, S., Raphaël Larrère, G., Bonnet, S., Nouët, J.-C., … Briard, L. (2019). Recommandation sur la technique d’amputation de phalange comme méthode d’identification et de caractérisation génétique chez les rongeurs. https://www.syrcle.network/
Norecopa. (2008). Toe clipping in mice: an evaluation of the method and
alternatives. norecopa.no
Pharmaseq. (2011). Tagging of Laboratory Mice Using Electronic p- Chips. www.pharmaseq.com
Poole, T. (1997). Happy animals make good science. Laboratory Animals, 31, 116–124.
Roughan, J. V., & Sevenoaks, T. (2019). Welfare and scientific considerations of tattooing and
ear tagging for mouse identification. Journal of the American Association for Laboratory Animal Science, 58(2), 142–153. https://doi.org/10.30802/AALAS-JAALAS-18-000057