- Blog
22/05/2025
Vous avez été impressionné.e par la précision du geste de l’infirmier.e qui vous a fait une prise de sang ? Alors imaginez l’expertise nécessaire pour faire la même chose… chez la souris !
Dans de nombreux domaines de recherche, des prélèvements de sang sont nécessaires pour mesurer la quantité de certaines molécules, évaluer les paramètres hormonaux, immunitaires, hématologiques, …
L’espèce la plus utilisée à des fins scientifiques est la souris (voir infographie Gircor), un petit mammifère de 25g en moyenne pour un volume de sang total de 1.5ml. Les recommandations du NC3R sur les volumes de sang pouvant être prélevés sont de maximum 10% du volume de sang total pour un prélèvement unique, et de maximum 15% au total pour des prélèvements répétés sur une durée de 28 jours. Chez l’humain, ces limites correspondent aux dons du sang : pour un individu de 70kg contenant 70ml de sang/kg, un prélèvement de sang total pour un don est de 480ml, correspondant à 9.8% du volume de sang total (très proche des 10% recommandés pour un prélèvement unique chez la souris).
Parfois, de petites quantités de sang sont suffisantes aux analyses nécessaires. Par exemple, les études de pharmacocinétique/pharmacodynamie nécessitent des prélèvements (pouvant être répétés) de moins de 50µl de sang pour mesurer une concentration par LC-MS (« Liquid Chromatography – Mass Spectrometry », une méthode d’analyse qui permet d’identifier et/ou de quantifier précisément de nombreuses substances). C’est notamment l’amélioration des protocoles de dosages (qui nécessitent moins de sang) qui a permis de réaliser des prises de sang répétées chez un seul animal. Cela permet de diminuer le nombre d’animaux nécessaire à une étude (Leblanc et al., 2018; Reddy et al., 2012).
Dans ces situations, plusieurs voies de prélèvement peuvent être utilisées, par exemple :
Figure 1 : Description de la méthode de prélèvement de sang au niveau de la veine mandibulaire chez la souris.

Figure 2 : Description de la méthode de prélèvement de sang au niveau de la veine saphène chez la souris.

Figure 3 : Description de la méthode de prélèvement de sang au niveau de la veine caudale chez la souris.

Dans tous les cas, la souris n’est jamais remise dans sa cage tant que le saignement n‘est pas arrêté.
Prélever plus de 200µl :
Parfois, notamment lorsque plusieurs analyses doivent être effectuées sur un seul prélèvement, il faut des quantités plus importantes de sang (plus de 200µl). Au-delà de 10% du volume de sang total, l’animal risque une anémie résultant du prélèvement. Dans ce cas, il est recommandé de faire le prélèvement sous anesthésie générale en geste terminal (l’animal est mis à mort en fin de procédure, sans réveil).
Dans cette situation, plusieurs voies de prélèvement peuvent être utilisées, par exemple :
Figure 4 : Description de la méthode de prélèvement de sang au niveau du cœur chez la souris.

Une analgésie doit être utilisée si des tissus sont incisés. Par exemple, le prélèvement intracardiaque peut être réalisé sans incision (si la formation des techniciens est suffisante) ; mais il est possible d’inciser la peau de l’animal anesthésié pour plus de précision. Dans ce cas une analgésie appropriée est nécessaire.
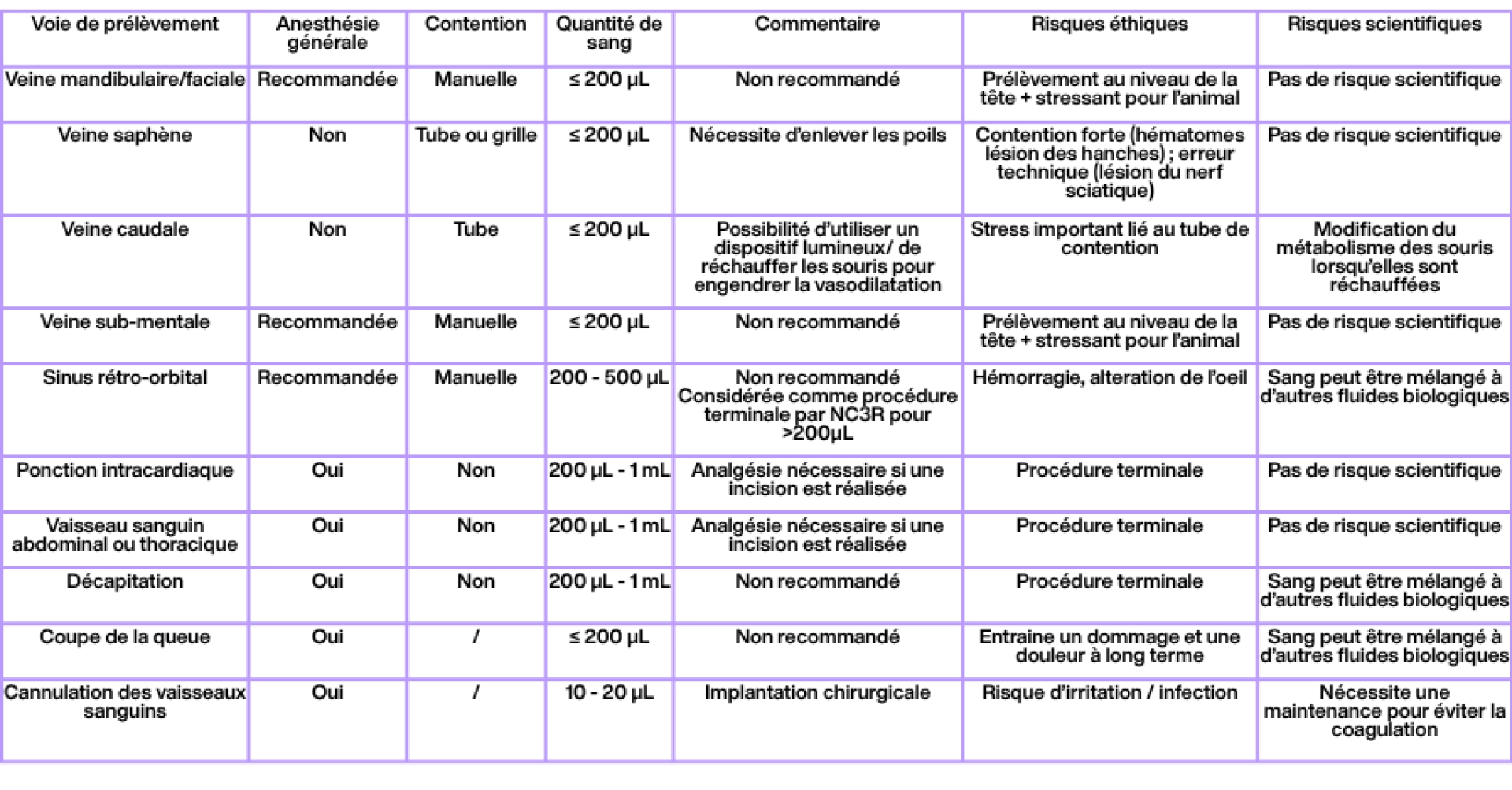
Les voies de prélèvement de sang sont donc nombreuses chez la souris. Elles doivent être sélectionnées avec soin, d’abord en fonction de critères scientifiques (quelle quantité est nécessaire, le sang doit-il être parfaitement « pur », …), puis en fonction de critères éthiques (quelle voie est la moins dangereuse, douloureuse, stressante pour l’animal). Ci-dessous, le Tableau 1 présente une liste non-exhaustive des voies de prélèvement de sang pouvant être utilisées chez la souris (les sources utilisées proviennent notamment du NC3R, du FC3R, et des études de Diehl et al., 2001; Meyer et al., 2020; Whittaker & Barker, 2020).
La hiérarchisation entre le choix scientifique et le choix éthique s’explique simplement par le fait que si le choix éthique était prioritaire, nous n’aurions plus recours aux animaux à des fins scientifiques.
La réhydratation :
Après un prélèvement important (entre 150 et 200µl), en cas de signes de déshydratation (retard du retour en place du pli de peau), et pour aider à restaurer la volémie et prévenir une déshydratation (lors d’une intervention chirurgicale par exemple), une réhydratation peut être nécessaire. Elle se fait avec du sérum physiologique réchauffé (entre 20 et 37°C selon le volume) administré par voie intrapéritonéale en curatif (réhydratation rapide mais voie modérément invasive et peu précise) ou par voie sous-cutanée en préventif (absorption plus lente mais voie moins invasive et moins risquée) (voir le blog « Comment administrer une substance à une souris »).
Tableau 1 : Liste non exhaustive des voies de prélèvement sanguin et de leurs caractéristiques. La colonne relative à l’anesthésie ne reflète pas une considération éthique, mais uniquement pratique : elle indique si la voie d’administration peut être techniquement réalisée sans anesthésie.
A TransCure bioServices, nous développons régulièrement de nouvelles procédures pour utiliser la plus grande variété de voies de prélèvement, afin de toujours sélectionner la plus pertinente scientifiquement et éthiquement. Nous prenons soin des animaux, mais aussi des techniciens en sélectionnant les voies qui ont le moins d’impact psychologique (la voie rétro-orbitale est très rarement utilisée, uniquement dans les cas où une justification scientifique prouve qu’elle est la plus adaptée).
Diehl, K.-H., Hull, R., Morton, D., Pfister, R., Rabemampianina, Y., Smith, D., Vidal, J.-M., & Van De Vorstenbosch, C. (2001). A Good Practice Guide to the Administration of Substances and Removal of Blood, Including Routes and Volumes. In JOURNAL OF APPLIED TOXICOLOGY J. Appl. Toxicol (Vol. 21).
Leblanc, A. F., Huang, K. M., Uddin, M. E., Anderson, J. T., Chen, M., & Hu, S. (2018). Murine Pharmacokinetic Studies. Bio-Protocol, 8(20), e3056. https://doi.org/10.21769/BIOPROTOC.3056
Meyer, N., Kröger, M., Thümmler, J., Tietze, L., Palme, R., & Touma, C. (2020). Impact of three commonly used blood sampling techniques on the welfare of laboratory mice: Taking the animal’s perspective. PLoS ONE, 15(9 september). https://doi.org/10.1371/journal.pone.0238895
Reddy, J., Madishetti, S., & Vachaspati, P. R. (2012). Fast mouse PK (Fast PK): A rapid screening method to increase pharmacokinetic throughput in pre-clinical drug discovery. European Journal of Pharmaceutical Sciences, 47(2), 444–450. https://doi.org/10.1016/J.EJPS.2012.07.001
Whittaker, A. L., & Barker, T. H. (2020). The impact of common recovery blood sampling methods, in mice (Mus musculus), on well-being and sample quality: A systematic review. In Animals (Vol. 10, Issue 6, pp. 1–32). MDPI AG. https://doi.org/10.3390/ani10060989